
(laatste aanpassing, 17 Augustus 1999)
Deze pagina is een Nederlandse bewerking van een document van Dr. Caroline Sewry op de Internet-site van de Muscular Dystrophy Group, de Engelse spierdystrofie patiŽntenvereniging. De vertaling werd gemaakt met de hulp van enkele direct betrokkenen. "KLIK HIER" om het origineel te bekijken.
Spierbiopten spelen vaak een beslissende rol bij de betrouwbare diagnose van de aard van het verval van de spierkracht. Maar wat gebeurt er met het schijfje spier nadat het bij de patiŽnt is afgenomen ?. Waar gaat het naar toe, hoe wordt het onder de microscoop onderzocht en wat kunnen de bevindingen zijn?.
Het belang van een goede diagnose
SpierdystrofieŽn zijn een groep aangeboren aandoeningen waarbij een toenemende spierzwakte optreedt tengevolge van de afbraak van spiervezels. Spierbiopten kunnen overeenkomsten aantonen tussen de verschillende vormen van spierdystrofie. Een betrouwbare diagnose is bijzonder belangrijk. Zonder zo'n diagnose kan de patiŽnt niet weten hoe zijn ziekte verder zal verlopen. Wanneer de diagnose een aangeboren afwijking aangeeft, dan kan er aan de patiŽnt verteld worden welke kans zijn of haar kinderen lopen om ook aan deze aandoening ten prooi te vallen. De diagnose kan er ook toe bijdragen om vast te stellen of andere leden in de familie van de patiŽnt onbewust mogelijk dezelfde aangeboren afwijking meedragen. Een spierbiopt kan zeer informatief zijn voor een diagnose. Daarnaast zijn andersoortige proeven evenzeer van belang: bloedonderzoek en electrische metingen aan spieren en zenuwen.
Wat is een spierbiopt
Een spierbiopt is een klein monstertje spierweefsel van slechts een paar millimeter in doorsnede. Gewoonlijk wordt het genomen uit de dij, de kuit, de schouder of de bovenarm. Al deze spieren zijn veilige plaatsen om een biopt te nemen omdat de belangrijke zenuwen en bloedvaten ver weg in het binnenste van de spieren lopen. Het is belangrijk dat een monster genomen wordt uit een spier die wel aangetast is, maar (nog) niet zo ernstig dat er te weinig spier over is voor onderzoek.
Spierbiopten worden gewoonlijk poliklinisch in een ziekenhuis afgenomen, waarbij slechts een plaatselijke verdoving nodig is, zoals bij de tandarts. Kinderen krijgen soms een voorbehandeling waardoor ze slaperig worden; in sommige ziekenhuizen kan een korte algehele verdoving toegepast worden. Zoals altijd bij neurologische aandoeningen moet het verdovingsmiddel zorgvuldig gekozen worden en het effect gedurende de verdoving nauwkeurig gevolgd worden.
Twee typen: een naaldbiopt / een open biopt
Bij de biopsie wordt een kleine snee in de huid aangebracht, waarbij de lengte afhankelijk is van de gebruikte methode. Bij een naaldbiopt is de snee slechts een paar millimeter lang, maar bij een open biopt is deze verscheidene centimeters lang. De naald, ongeveer 5 millimeter in doorsnede, wordt snel via de snee ingebracht en het monster wordt in enkele seconden genomen. Na de biopsie wordt de insnede weer samengevoegd met een hechtpleistertje, hechtingen zijn niet nodig.. Het litteken dat achterblijft is erg klein. Bij een open biopt duurt de monstername wat langer omdat het monster losgesneden moet worden van het spierweefsel. Hechtingen zijn nodig en er blijft een litteken bestaan. Beide methodes hebben voor- en nadelen en het hangt van het ziekenhuis af waaraan de voorkeur wordt gegeven.
Een snelle en doelmatige verwerking van het biopsie materiaal is onontbeerlijk voor goede diagnostische resultaten. Voor latere bestudering met de electronenmicroscoop van de fijnstructuur van de spiervezels wordt gewoonlijk een klein plakje van het monster afgesneden en in een conserveringsmiddel gestopt. Wanneer biochemisch onderzoek naar de spiereiwitten volgt, wordt de rest snel ingevroren in vloeibare stikstof (-160oC). Het bevriezen van het weefsel geeft het materiaal de stevigheid om het tot zeer dunne plakjes te kunnen snijden, terwijl het tevens de activiteit van enzymen en andere eiwitten in de spiervezels bewaard. Uit het bevroren monster worden plakjes gesneden die slechts een fractie van een millimeter dik zijn. Ze worden opgevangen op microscoopglaasjes en gekleurd met kleurstoffen die de structuur van het weefsel onthullen.
Gezond spierweefsel
Gezond spierweefsel (Fig.1a) is opgebouwd uit vezels van ongeveer gelijke doorsnede, die dicht tegen elkaar aanliggen. Ze worden omgeven door bindweefsel wat zelden tussen de vezels aanwezig is. Elke vezel bevat meerdere celkernen die langs de buitenkant liggen. De celkernen bevatten het DNA, onze genen. Tussen de vezels bevinden zich bloedvaten die de voedingsstoffen en de zuurstof naar de spiervezels brengen. Af en toe is nog een kleine zenuw zichtbaar die de prikkel voor het samentrekken van de spier overbrengt.
Ziek spierweefsel
In door spierdystrofie aangedaan spierweefsel (Fig.1b) is de doorsnede van de vezels sterk verschillend. Sommige vezels worden door kleurstoffen sterker gekleurd ten teken dat ze ernstiger beschadigd zijn terwijl andere vezels juist bleker blijven omdat ze zijn afgestorven. Nieuwe vezels kunnen echter gevormd worden en deze zijn zichtbaar als groepjes kleinere vezels met andere kleureigenschappen. In tegenstelling tot gezond weefsel worden bij ziek weefsel de vezels van elkaar gescheiden door bindweefsel en vet dat vaak als vlekjes tussen de vezels verschijnt. Sommige celkernen bevinden zich binnenin de vezel en niet aan de rand, terwijl een aantal vezels gespleten of anderszins kapot is.
Het beeld van spieren met een dystrofie verschilt duidelijk van dat waarbij aandoeningen van de zenuwen / zenuwcellen in het geding zijn (zoals bijv. bij spinale spieratrofie). In dat geval worden groepjes dunne vezels naast groepjes dikke vezels gevonden (Fig.1c). In het geval van dermatomyositis is er vaak een kenmerkend optreden van dunne vezels aan de rand van een vezelbundel (Fig.1d).
a c |
|
b d |
Doorsnedes van spierweefsel onder de microscoop
a. normaal, gezond spierweefsel, b. een biopt van een jongen met
Duchenne spierdystrofie, c. een biopt van een patiŽnt met spinale
spieratrophy en d. een biopt van een patiŽnt met dermatomyositis. Let op
de verschillen tussen kleine en grote vezels, de aanwezigheid van bindweefsel en de
ligging van de celkernen. N = celkern, CT = bindweefsel (connective tissue).
Verschillende soorten spiervezels
Een spiervezel is samengesteld uit twee hoofdtypes vezels die verschillen in functie en biochemische eigenschappen. Dit verschil is duidelijk zichtbaar bij dieren als kippen, die wit vlees op hun borst hebben en rood vlees aan hun poten. Bij mensen zijn de verschillen niet zo opvallend. De enzymen die bij de onderscheiden vezeltypes behoren verschillen in hun reacties met kleurstoffen en zo kan onder de microscoop het verschil zichtbaar gemaakt worden. Bij gezond spierweefsel levert dit een mozaiek op van licht en donker gekleurde vezels, maar bij ziek spierweefsel treden afwijkingen op.
Bij spieren met dystrofie zijn er meer vezels voor het handhaven van een bepaalde houding dan voor snelle handelingen zoals hardlopen. Dit komt ook voor bij andere spierziekten. Bij de spinale spier-atrofie zijn de dikke vezels allemaal van het ene soort terwijl de dunne vezels van de andere soort of van een gemengde samenstelling zijn. Het wegkwijnen van slechts ťťn soort vezels komt wel voor in aandoeningen zoals myotone dystrofie en een aantal aangeboren myopathieŽn zoals "centronuclear myopatie", een aandoening waarbij de celkernen middenin de vezels liggen.
Veranderingen in de opbouw van de spiervezels
Bij een aantal ziekten vertoont het weefsel onder de microscoop gebreken in de opbouw. In "nemaline myopathie" komen groepjes kleine staaf-vormige deeltjes voor. Bij mitochondriale spierziektes zijn het de mitochondrieŽn, de energiecentrales van de vezels, die aanwezig zijn in een afwijkende vorm, grootte, opbouw of samenstelling. Andere veranderingen treden op in de myofibrillen, d.w.z. de onderdelen van de vezels die langs elkaar kunnen schuiven om de spier te laten samentrekken. Bij de "central core ziekte" is het binnenste deel van de vezel verbroken en zijn er te weinig mitochondrieŽn, terwijl bij de zg. mini-core ziekte deze breuk kleiner is maar door de gehele vezel heen optreedt.
Onderzoek naar enzymen en de ophoping van producten
Bij bepaalde aandoeningen kan een enzym afwezig zijn dat nodig is voor een chemische reactie in het weefsel. Bijvoorbeeld in de ziekte van McArdle is een enzym afwezig dat betrokken is bij de afbraak van suikers, een ...phosphorylase. Het gevolg hiervan is dat een stijfselachtige stof, glycogeen, zich ophoopt. Bij andere stofwisselingsziekten treedt een ophoping op van vet of glycogeen. Bij sommige mitochondriale ziekten ontbreekt het enzym cytochrome-oxidase in een aantal vezels.
Antilichamen
Antilichamen worden in het laboratorium gemaakt en wanneer ze in contact worden gebracht met een stukje spierweefsel hechten zij zich slechts aan ťťn bepaald eiwit. Het beschikbaar komen van antilichamen gericht tegen verschillende in de spier voorkomende eiwitten, heeft een enorme verbetering gegeven om spierbiopten te kunnen beoordelen. Door de antilichamen te voorzien van een merkteken, dat zichtbaar gemaakt kan worden onder de microscoop, kunnen de onderzoekers zien of en waar de antilichamen gebonden worden. Op die plaats is het beoogde eiwit dus aanwezig en elders niet. In de figuren 2 en 3 was het merkteken fluorescerend, zodat met een speciale lamp door de microscoop kon worden gezien waar het eiwit zich bevond.
Dystrofine kleuringen
Antilichamen zijn nu beschikbaar tegen diverse eiwitten die in spieren voorkomen. Zij stellen ons in staat onderscheid te maken tussen aandoeningen waarvan het ziektebeeld veel op elkaar lijkt. Een goed voorbeeld hiervan zijn Duchenne en Becker spierdystrofie enerzijds en Limb-girdle dystrofie anderzijds. Bij Duchenne spierdystrofie ontbreekt het eiwit dystrofine geheel of bijna geheel, terwijl bij de Becker spierdystrofie dystrofine wel aanwezig is maar in een te lage hoeveelheid of ongelijk verdeeld (Fig.2).
a c |
|
b d |
Spierweefsel gekleurd met antilichamen tegen dystrofine
a. bij normale spieren zit het dystrofine aan de rand van elke vezel, b.
bij jongens met Duchenne spierdystrofie is het dystrofine
afwezig, c. bij jongens met Becker spierdystrofie
is er minder dystrofine en het komt ongelijk verdeeld voor en d. bij
sommige jongens met Duchenne spierdystrofie kunnen een paar vezels wel dystrofine
bevatten, maar dat is onvoldoende om een effect te hebben op het functioneren van de
spier.
Draagsters van Duchenne spierdystrofie
Antilichamen zijn ook zeer nuttig om vast te stellen of iemand een draagster is voor de ziekte van Duchenne. Hoewel de meeste draagsters geen symptomen van de ziekte vertonen, kunnen er in hun spieren wel kleine veranderingen optreden in de hoeveelheid en de verdeling van het dystrofine (Fig.3a) Soms vertoont een enkele vezel geen aanwezigheid van dystrofine. Af en toe komen er verscheidene vezels voor zonder dystrofine en in deze zeldzame gevallen kan een draagster aan spierzwakte lijden (Fig.3b). Dit kan er toe bijdragen om draagsters van Duchenne te onderscheiden van patiŽnten met "Limb-girdle" dystrofie. Bij een duidelijke draagster komt een mozaiek voor van vezels deels met en deels zonder dystrofine, maar bij patiŽnten met "Limb-girdle" dystofie is het dystrofine normaal.
a |
|
b |
Dystrofine kleuringen: draagster detectie
Het spierweefsel is aangekleurd met antilichamen tegen dystrofine. a. bij
de meeste draagsters wordt slechts een ongelijkmatigheid in de verdeling van dystrofine
gezien; b. bij een draagster met een uitgesproken spierzwakte ontbreekt
soms in een aantal spiervezels het dystrofine en wordt een mozaiek van positieve en
negatieve vezels gezien. Een degelijk patroon treedt niet op bij patiŽnten met
"Limb-girdle" dystrofie.
Bij sommige vormen van Limb-girdle spierdystrofie kan met antilichamen vastgesteld worden dat andere eiwitten, sarcoglycanen genaamd, in de spieren ontbreken. De sarcoglycanen bevinden zich ook aan het oppervlak van de vezels en ze zijn een van de bestanddelen van een groep eiwitten die een complex vormen met dystrofine, het zogenaamde dystrofine geassocieerde eiwitcomplex (Fig.4). De oorzaak voor het tekort aan sarcoglycanen is niet in alle gevallen dezelfde en kan veroorzaakt worden door veranderingen in tenminste vier verschillende genen. Het onderzoek naar de aanwezigheid van sarcoglycanen in spierbiopten vormt het begin van een moleculair onderzoek en voor het onderscheiden van verschillende typen van "Limb-girdle" spierdystrofie.
Het samenstel van eiwitten met dystrofine is aan de buitenzijde van de vezel verbonden met een complexe deklaag van de vezel. Een tekort in ťťn bestanddeel van deze deklaag, namelijk het eiwit merosine, komt voor bij ongeveer de helft van de gevallen met een aangeboren spierdystrofie (congenitale spierdystrofie). Wanneer het spierbiopt de afwezigheid van merosine toont dan is dit van belang voor de diagnose tijdens de zwangerschap.
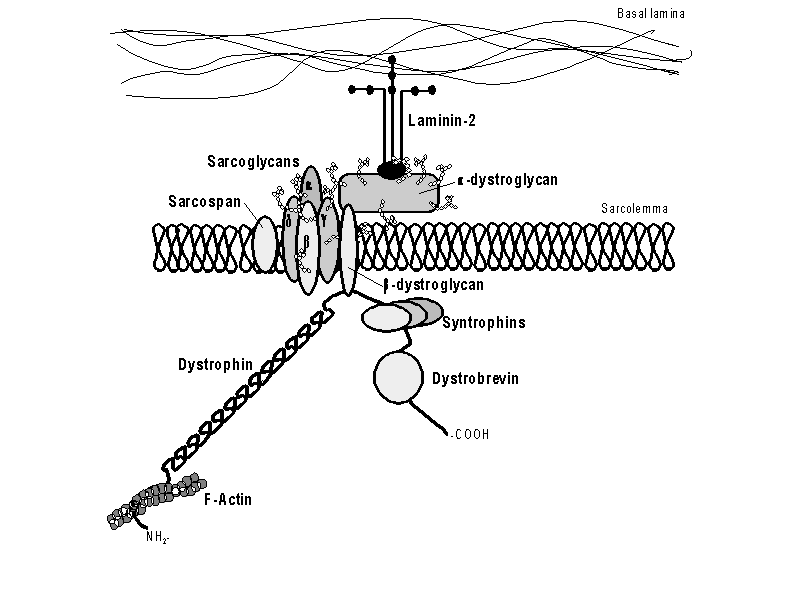
Het eiwitcomplex met dystrofine en de sarcoglycanen
Het is dus duidelijk dat de spiervezels het gehele samenstel van eiwitten met dystrofine nodig hebben en dat de buitenste deklaag intact moet zijn om normaal te kunnen functioneren. Het ontbreken van slechts ťťn verbinding in dit samenstel kan leiden tot een neuromusculaire aandoening. Het is waarschijnlijk dat andere spieraandoeningen samenhangen met afwijkingen in andere eiwitten binnen dit complex.
Niet alleen deze tekorten aan bijzondere eiwitten kunnen vastgesteld worden met antilichamen, maar ook andere onregelmatigheden. Zo is het regel dat bij polymyositis en dermatomyositis veel vezels worden gevonden die afwijkende hoeveelheden van een eiwit bevatten, het zogenaamde "class 1 major histocompatibility complex", dat van belang is voor het immuun systeem van het lichaam. Dit leidt er toe dat het lichaam de spier als een indringer ziet en dus wil verwijderen, hetgeen een belangrijke oorzaak is voor het ontstaan van ontstekingen.
Dr Caroline Sewry, de originele auteur is verbonden aan het Hammersmith Ziekenhuis te Londen. Zij zorgt voor de diagnose van spieraandoeningen m.b.v. spierbiopten. Daarnaast is zij sinds 1970 betrokken bij verscheidene onderzoeken naar neuromusculaire ziekten. Dit onderzoek wordt deels financieel gesteund door de "Muscular Dystrophy Campaign" (de MDC) in Engeland. Een Engelstalige brochure getiteld "Carrier detection tests and prenatal testing of inherited neuromuscular conditions" is verkrijgbaar via de MDC.